METODE IMMOBILISASI ENZIM
Pada umumnya penggunaan enzim hanya terbatas sekali pakai saja, sehingga
setiap mulai pengolahan atau analisis harus menggunakan enzim baru.
Untuk mengatasi kekurangan kekurangan dalam
penggunaan enzim konvensional, teknologi enzim membuat enzim amobil baik untuk tujuan
proses pengolahan dengan sistem batch maupun proses dengan sistem kontinyu.
Enzim amobil adalah suatu enzim yang secara
fisik maupun kimia tidak bebas bergerak sehingga dapat dikendalikan atau diatur
kapan enzim harus kontak dengan substrat. Amobilisasi
enzim adalah suatu proses di mana pergerakan molekul enzim ditahan pada tempat
tertentu dalam suatu ruang reaksi kima yang dikatalisnya. Proses ini dapat
dilakukan dengan cara mengikatkan molekul enzim tersebut pada suatu bahan
pendukung (matriks) tertentu melalui pengikatan kimia atau menahan secara fisik
dalam suatu rongga bahan pendukung. Hal ini dimungkinkan karena molekul enzim
yang struktural globular (tertier maupun kuartener) mempunyai gugus hidrofilik
yang mengarah keluar dari permukaan molekul enzim. Gugus fungsi inilah yang
berikatan dengan gugus fungsi bahan pendukung untuk membentuk ikatan kovalen
atau non kovalen. Tehnik amobilisasi enzim dapat dilakukan denga 3 cara yaitu :
1.
Cara fisik yang meliputi tehnik (penjebakan)
entrapment, (encapsulation).
2.
Cara kimia yaitu meliputi tehnik
pengikatan baik secara kovalen, non kovalen dan tehnik ikatan silang
(crosslinking).
3.
Kombinasi cara fisik dan kimia.
Bahan pendukung yang banyak
digunakan dalam amobiliasi enzim adalah kalsium alginat, kappa-karagenan,
poliakrilamida, dan resin sintesis.
Reaksi
enzimatik dengan enzim teramobilisasi telah terbukti sebagai teknik yang
efisien dalam beberapa aplikasi industri. Sampai saat ini banyak metode
amobilisasi yang telah dikembangkan. Namun demikian, teknik konvensional
mempunyai kendala yang sangat mengganggu, yaitu tidak dapat mereduksi efek
inhibisi. Teknik amobilisasi secara fisik menggunakan media berpori menawarkan
beberapa keuntungan dibandingkan dengan teknik amobilisasi konvensional
seperti: aktivitas enzim tetap tinggi (tidak terjadi konformasi enzim, media
dapat diregenerasi, sesuai untuk kasus yang melibatkan substrat dan produk
dengan berat molekul yang hampir sama. Penyisihan satu atau lebih jenis produk
inhibitor secara sinambung merupakan keunggulan menarik lain dan teknik ini.
Penelitian baru baru ini dilakukan dengan mempelajari mekanisme penjebakan
enzim pada media mikroporous dan mempelajari pengaruh berbagai parameter
operasi terhadap perolehan amobilisasi (%) dan densitas amobilisasi
(unit aktivitas enzim per satuan volume media).
Tahapan
penelitian yang telah dilaksanakan meliputi karakterisasi enzim, karakterisasi
membran, studi stabilitas membran, desain modul dan amobilisasi enzim.
Karakterisasi enzim dilakukan untuk mengetahui berat molekul dan aktivitas
enzim. Sedangkan karakterisasi membran yang diuji adalah ukuran pori dan
struktur pori. Penentuan ukuran pori dilakukan dengan Metode Bubble Point,
sedangkan struktur pori diketahui menggunakan Scanning Electron Microscopy
(SEM). Dalam penelitian mi digunakan enzim pemecah pati (o~-amylase dan
~3-amylase) dan membran Polietersulfon (PES). Hasil karakterisasi membran
menunjukkan bahwa PES memiliki ukuran pori 0,2 ~tm dan struktur pori reverse
asymmetric sehingga sesuai dengan spesifikasi yang diharapkan sebagai membran
mikrofiltrasi dengan permeabilitas awal membran sebesar 46,88 tim2,
jam. Desain modul membran telah dilakukan dengan spesiflkasi: diameter fiber
1,7 mm; panjang efektif 20 cm; jumlah fiber setiap modul 4 buah dan luas
membran 42 cm2.
Mekanisme
penjebakan enzim dengan membandingkan permeabilitas air rnurni sebelum dan
setelah penjebakan enzim menunjukkan bahwa penurunan fluks setelah penjebakan
berkisar 78-80 % dan fluks awal. Sedangkan mekanisme penjebakan enzim dengan
pengontakan larutan enzim ke permukaan membran menunjukkan bahwa adsorbsi
amilase pada permukaan membran terhadap penurunan kinerja membran sekitar 8-9 %.
Pengaruh tekanan terhadap amobilisasi enzim dilakukan pada tekanan 0,4;
0,8; dan 1,2 kg/cm2. Penelitian menunjukkan bahwa penurunan fluks
pada menit-menit awal mungkinan terjadinya ~p beban penjebakan ,ariasikan
konsntrasi nobilisasi maksimum semakin tajam dengan meningkatnya TMP, semakin
tinggi TMP kemungkinan terjadinya konsolidasi protein semakin besar. Pengaruh
konsentrasi enzim terhadap beban penjebakan/perolehan amobilisasi dan aktivitas
dilakukan dengan cara memvariasikan konsentrasi enzim. Hasil penelitian menunjukkan
bahwa persentase perolehan amobilisasi maksimum dicapai pada konsentrasi enzim
1300 UAIL sebesar 85%.
Beberapa
tehnik amobilisasi enzim terbaru adalah sebagai berikut :
1.
POLIMER KITIN SEBAGAI
MEDIA PENDUKUNG AMOBILISASI ENZIM α-AMILASE
Menurut
Bailey dan Ollis (1988), amobilisasi enzim menjadi menarik jika substrat yang
dibutuhkan sangat banyak atau enzim yang bersangkutan mahal. Wirawan (1988),
juga menjelaskan bahwa penggunaan enzim teramobilisasi dibatasi oleh mahalnya
harga bahan pendukung, oleh karena itu diperlukan bahan pendukung yang murah,
tersedia dalam jumlah besar serta memiliki sifat menguntungkan.
Kitin adalah
polisakarida paling melimpah kedua di alam setelah selulosa. Kitin terdapat
dalam komponen srtuktural eksoskeleton dari serangga dan krustacea, juga
terdapat di dalam dinding sel ragi dan jamur yang jumlahnya berkisar antara
30-60 %. Kitin dilaporkan telah dapat digunakan sebagai bahan pendukung untuk
beberapa enzim, seperti papain, laktase, kimotripsin, asam pospatase, dan
glukosa isomerase. Sebagai bahan pendukung enzim penggunaannya yang terbesar
adalah pada industri makanan dan kosmetik (Peter,1995).
Amobilisasi
enzim pada kitin dapat dilakukan dengan metode adsorpsi sederhana, dengan
adsorpsi pada kitin yang diaktifkan dengan glutaraldehid, atau dengan ikatan
silang dari enzim dan pendukung dengan glutaraldehid. Ikatan silang dengan
glutaraldehid menyebabkan penurunan aktivitas enzim sebesar 14 – 60%
(Synowiecki,1982). Metode adsorpsi fisik merupakan salah satu metode
amobilisasi enzim yang sederhana dan efektif karena sedikit atau tidak
menyebabkan perubahan konformasi enzim, atau destruksi pada pusat aktif enzim.
Pada
penelitian ini telah berhasil dilakukan amobilisasi enzim α-amilase dengan
bahan pendukung polimer kitin menggunakan metode adsorpsi fisik, dan didapatkan
kondisi optimum untuk enzim α-amilase bebas dan amobil, yang meliputi pH
optimum, suhu optimum, dan waktu inkubasi optimum.
2.
IMMOBILISASI ENZIM GLUCOSE
OXIDASE (GOD) dan HORSE RADISH PEROXIDASE (HRP) DENGAN METODE
SOL-GEL
Berbagai
macam teknik immobilisasi telah digunakan, meliputi adsorpsi pada penyangga
padat (Yao dkk.,2007; Wang dkk.,2009), pengikatan kovalen (Kunzelmann &
Botther, 2007; Wu dkk., 1999) dan pemerangkapan dalam polimer (Fei dkk., 2003;
Li dkk., 2004; Pan dkk., 2005; Hiratsuka dkk., 2008). Pada umumnya, teknik
adsorpsi mudah dilakukan, tetapi ikatan enzim seringkali lemah yang menyebabkan
perembesan keluar dan biokatalis seperti itu derajat kestabilannya kurang.
Sebaliknya, teknik kovalen membutuhkan waktu yang sangat lama dan seringkali
memerlukan beberapa tahap kimia. Immobilisasi, meskipun mencegah perembesan
keluar tetapi seringkali mengarah kepada kehilangan aktivitas dan stabilitas
enzim seiring dengan berjalannya waktu (Gupta dkk., 2007). Dari beberapa teknik
immobilisasi yang telah dilakukan di atas, dapat disimpulkan bahwa proses
pemerangkapan enzim harus memperhatikan aktifitas dan kestabilan enzim yang
akan digunakan.
Sol-gel
menawarkan cara yang lebih baik untuk mengimmobilisasi biomolekul dengan
matriksnya yang berpori dan menunjukkan aktivitas fungsional biomolekul yang
terselubungi (Coardin dkk.,2006: Gupta dkk.,2007). Hal ini disebabkan kondisi
proses sol-gel yang sederhana dan kemungkinan untuk merancang sesuai kebutuhan.
Fleksibilitas sol-gel mengijinkan membentuk sensor sebagai monolith dan lapisan
tipis yang dapat dipasangkan dengan serat optik atau dideposisikan pada
elektroda, maupun sebagai nanopartikel.
Pengembangan
teknik sol-gel terutama berbasis pada silikon alkoksida Si(OR)n, dimana R
adalah gugus organik (-CH3, -C2H5, ...) (Hench, 1998). Dengan kehadiran air,
terjadi hidrolisis gugus Si-OR yang menciptakan gugus silanol Si-OH dan
melepaskan molekul alkohol ROH terkait. Kemudian terjadi kondensasi antara gugus
silanol yang membentuk ikatan Si-O-Si. Reaksi kondensasi yang mengikuti proses
polimerisasi anorganik menghasilkan pembentukan nanopartikel SiO2. Setelah sol
menjadi gel, enzim terperangkap dalam jaringan polimetrik gel berpori. Molekul
enzim terperangkap dalam jaringan kovalen daripada terikat secara kimia pada
matriks silika gel sehingga aktivitas fungsional biomolekul masih tetap tinggi
(Coradin dkk., 2006).
Pada umumnya
biosensor glukosa berbasis sol-gel melibatkan pemerangkapan serempak enzim glucose
oxidase (GOD) dan horse radish peroxsidase (HRP) dalam silica gel berbasis
tetramethyl orthosilicate (TMOS) dan tetraethyl orthosilicate (TEOS) (Singh
dkk., 2007: Liang dkk., 2008). TEOS dan TMOS merupakan precursor yang efektif
untuk pembentukan sol-gel dan berbagai macam biosensor berbasis sol-gel yang
berdasarkan pada prinsip transduksi yang berbeda yang membentang dari
elektrokimia (amperometric dan coulorometric), optic, piezo-electric, dan
thermal, telah dikembangkan (Mehrvar & Abdi, 2004). Transducer merupakan
alat yang penting untuk mengkonversi perubahan yang terjadi karena reaksi
redoks. Sensor optik memantau reaksi melalui reaksi H2O2/HRP dye organic yang
dimasukkan dalam supernatant gel. Sensor thermal memantau reaksi enzimatik
berdasarkan pada perubahan entalpi dari sistem reaksi (Ramanathan dkk., 2001).
Teknik yang paling populer adalah dengan teknik elektrokimia. Keunggulan utama
teknik elektrokimia untuk pemantauan glukosa darah adalah bahwa bagian aktif
biosensor dimana darah tidak perlu berkontak langsung dengan alat ukurnya
sendiri. Hal ini mengurangi kebutuhan untuk membersihkan alat dan mengurangi
peluang untuk kontaminasi dengan spesimen darah yang mungkin terinfeksi oleh
penyakit lain.
Akan tetapi,
biosensor berbasis sol-gel ini mempunyai beberapa kelemahan, yaitu langkah
pembentukkan sol gel melibatkan pH yang ekstrim dan konsentrasi alkohol yang
tinggi yang dapat merusak stabilitas enzim dan struktur lapisan sol-gel silika
yang porous cenderung menyebabkan enzim merembes keluar sehingga stabilitas
sensor menjadi jelek (Coradin dkk., 2007; Gupta & Chaudury, 2007). Hal ini
mendorong perlunya mengembangkan suatu teknik dimana kedua kendala tersebut
dapat diatasi.
Oleh karena
itu, penelitian ini bertujuan untuk mengembangkan teknik immobilisasi enzim
GOD/HRP ke dalam silika gel dengan teknik sol-gel untuk aplikasi biosensor
glukosa dengan mempelajari pengaruh kondisi operasi pembuatan sol-gel yaitu
konsentrasi silika dalam sol terhadap diameter pori lapisan sol gel silika
serta mempelajari pengaruh diameter pori, suhu, dan pH terhadap aktivitas dan
stabilitas enzim yang diimmobilisasi. Metode sol gel yang menawarkan
fleksibilitas yang tinggi untuk membentuk sensor, sederhana, dan murah
diharapkan mampu menyediakan biosensor yang terjangkau masyarakat luas. Hal ini
jelas merupakan upaya yang sangat berharga untuk menyelesaikan isu nasional
tentang mahalnya alat kesehatan.
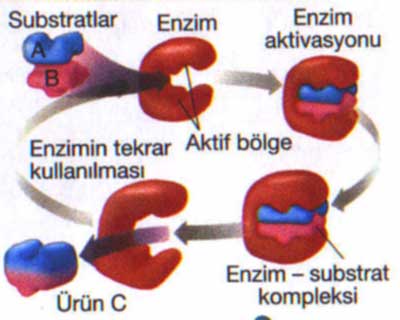
Penggunaan
enzim dalam yang telah diisolasi sebagai molekul bebas, yakni terlarut dalam
air, dalam analisis kurang menguntungkan, karena enzim hanya dapat digunakan
untuk satu kali reaksi dan enzim tersebut sulit dipisahkan dari produk dan
substrat. Agar enzim tersebut dapat dipakai berulang dan dapat dipisahkan maka
dapat digunakan suatu metode yaitu teknik imobilisasi enzim.
Imobilisasi
enzim dapat dianggap sebagai metode yang merubah enzim dari bentuk larut dalam
air “bergerak” menjadi keadaan “tak begerak” yang tidak larut Imobilisasi dmencegah
difusi enzim ke dalam campuran reaksi dan mempermudah memperoleh kembali enzim
tersebut dari aliran produk dengan teknik pemisahan padat/cair yang sederhana.
Imobilisasi dapat dilakukan dengan berbagai cara, antara lain melalui
pengikatan kimiawi molekul enzim pada bahan pendukung, pengikatan silang
intermolekuler sesama enzim, atau dengan cara menjebak enzim di dalam gel atau
membran polimer (Palmer, 1991).
Beberapa
keuntungan penggunaan enzim amobil daripada enzim bebas antara lain
meningkatkan stabilitas enzim, mengurangi jumlah enzim yang digunakan,
mempermudah untuk pemisahan dan enzim untuk digunakan kembali, kemudahan untuk
penggunaan selanjutnya, mempermudah untuk memisahkan hasil, dan pada beberapa
kasus dapat meningkatkan aktivitas enzim (Nam Sung Wang, Jurnal “Enzyme
Immobilization By Gel Entrapment”).
Teknik
imobilisasi yang paling baik untuk dipilih adalah yang memenuhi kriteria utama
yakni tidak terjadi perubahan konformasi enzim dan tidak mengganggu gugus
fungsi di pusat aktif enzim sehingga enzim tetap dapat berfungsi. Metode
penjebakan enzim lebih banyak digunakan karena enzim ada dalam keadaan bebas
dan tidak terikat pada bahan pendukung sehinga secara relatif fungsi katalitik
dan struktur alami molekul enzim tidak mengalami gangguan goncangan (Kierstan
& Coughlan 1985, Wirahadikusumah 1988).
Escherichia
coli digunakan sebagai strain untuk percobaan karena memiliki sekitar 2000
jenis enzim dan beberapa strain yang telah dilaporkan mampu menghasilkan enzim
galaktosidase yang akan mengkatalisis hidrolisis ikatan ?-galaktosida. Selain
itu, E.coli mudah untuk diperoleh, dikembangbiakkan dan mudah ditangani. Sebab
pada suhu kamar E.coli dapat ditumbuhkan, dan canderung resisten terhadap
beberapa bakteri patogen.
Uji
aktivitas dilakukan dengan menggunakan ONPG sebagai sustrat. Pada keadaan
alkalis, hasil penguraian ONPG oleh enzim galaktosidase akan membentuk warna
sehingga dapat diukur absorbansinya pada panjang gelombang 420 nm.
Bakteri
Escherichia coli menghasilkan berbagai macam enzim salah satunya yaitu
galaktosidase. galaktosidase merupakan substrat chromogenic artifisial. Suhu
dan pH optimum galaktosidase yaitu 42°C dan 5,8. Dalam percobaan galaktosidase
diperoleh dari kultur sel E.coli pada media fermentasi. Jumlah sel yang perlu
ditambahkan ke dalam media fermentasi ditentukan berdasarkan nilai Optical
Dencity (OD) pada 620nm. Dari percobaan diperoleh hasil sebesar 2,7608mL untuk
jumlah OD yang ditambahkan, tetapi dalam perlakuannya ditambahkan 5,6mL
inokulum bakteri agar diperoleh pasta sel yang lebih banyak. Pasta sel total
yang diperoleh yaitu sebesar 0.85 g dan jumlah pasta gabungan dari keempat
kelompok sebesar1.0897 g.
Pembentukan
gel dipercepat dengan mereaksikan kaliun persulfat dan TEMED ke dalam campuran.
Pasta sel yang diambil untuk pembuatan sel amobil seberat 0,2800g. Campuran
dicetak dalam gelas piala kecil dan disimpan pada suhu 5°C karena panas yang
tinggi dapat menyebabkan enzim terdenaturasi sehingga menyebabkan inaktivasi
enzim dan menghambat proses isolasi enzim. Metode penjebakan enzim dalam gel
sangat lunak dan tidak ada modifikasi kimia atas enzim sehingga tidak akan
merusak aktivitas enzim. Enzim yang terjebak dalam volume gel tersebut tetap
berada dalam bentuk aslinya tanpa resiko adanya penutupan bagian aktif, gugus
atau molekul enzim oleh ikatan kimia.
Penerapan teknik amobilisasi sel untuk menghidrolisis ikatan tersebut memberikan beberapa keuntungan antara lain, diperoleh stabilitas enzim yang lebih tinggi, enzim dapat digunakan berulang kali, tidak diperlukan isolasi dan pemurnian enzim, proses kontinu dapat dikerjakan lebih sederhana dan praktis, serta pengendalian reaksi enzimatis dapat diatur lebih baik
Penerapan teknik amobilisasi sel untuk menghidrolisis ikatan tersebut memberikan beberapa keuntungan antara lain, diperoleh stabilitas enzim yang lebih tinggi, enzim dapat digunakan berulang kali, tidak diperlukan isolasi dan pemurnian enzim, proses kontinu dapat dikerjakan lebih sederhana dan praktis, serta pengendalian reaksi enzimatis dapat diatur lebih baik
Pada
percobaan kedua jenis enzim ?- galaktosidase sel amobil dan bebas mendapatkan
perlakuan yang sama yaitu enzim diukur dalam kondisi yang sama yaitu pada suhu
ruang (37 °C) dan pada pH 7,7 yang merupakan pH optimum dari buffer fosfat.
Kondisi ini bukan merupakan kondisi optimum dari ?- galaktosidase, suhu dan pH
optimum galaktosidase yaitu 42°C dan 5,8. Pengujian aktivitas ?- galaktosidase
menggunakan substrat ONPG 2,5mM. Dalam keadaan alkalis ?- galaktosidase
menguraikan ONPG menjadi senyawa berwarna kuning yaitu nitrofenol. Penghentian
reaksi dilakukan dengan cara menambahkan Na2CO3. Pengukuran dilakukan dengan
metode spektrofotometri pada 420nm. Dari perobaan ini diharapkan akan
memberikan hasil yang tepat pada jumlah sampel yang banyak pengukuran aktivitas
assay enzim berdasarkan pada perubahan intensitas cahaya yang diabsorbsi oleh
larutan yang telah ditambah reagen. Intensitas warna kuning setara dengan
banyaknya aktivitas enzim tersebut.
Untuk dapat
menentukan konsentrasi nitrofenol hasil degradasi ONPG oleh enzim, diperlukan
satu kurva standar nitrofenol. Dari hasil percobaan didapatkan persamaan kurva
standar yaitu Y= 6,3423X + 0,3837 dengan R2 sebesar 87,13%. Berdasarkan kurva
persamaan diatas maka dapat ditentukan konsentrasi konsentrasi produk
nitrofenol dan aktivitas spesifik enzim baik yang amobil maupun yang bebas.
Terlihat bahwa imobilisasi ada enzim mengakibatkan penurunan konsentrasi produk
dan aktivitas spesifik enzim tersebut berdasarkan hasil yang diperoleh dari
tabel.
4.
PEMANFAATAN KITOSAN
DARI CANGKANG UDANG SEBAGAI MATRIKS PENYANGGA PADA IMOBILISASI ENZIM PROTEASE
Udang
sebagai salah satu komoditas andalan sektor perikanan, setiap tahunnya
mengalami peningkatan produksi. Proses pembekuan udang untuk ekspor,
menghasilkan limbah sekitar 60- 70%. Limbah cangkang udang tersebut dapat
diolah menjadi kitosan. Kitosan dijadikan sebagai alternatif pilihan pengganti
matriks penyangga pada imobilisasi enzim karena kitosan memilik beberapa
keunggulan dibandingkan matriks sintetik lainnya. Keunggulan kitosan yaitu,
bentuk fisiknya dapat diubah (serpihan, manik-manik berpori, gel, fiber,
membran), biodegradasi, murah, mudah penanganannya, memiliki afinitas yang
tinggi pada protein dan non toksik.
Tujuan
penelitian ini adalah untuk memanfaatkan dan mengetahui kemampuan kitosan
sebagai matriks penyangga pada imobilisasi enzim protease. Penelitian dilakukan
dalam dua tahap yaitu penelitian pendahuluan berupa pembuatan kitosan dan
mengukur mutu kitosan yang dihasilkan, meliputi kadar air, kadar abu, kadar
nitrogen, viskositas dan derajat deasetilasi. Penelitian utama yaitu
imobilisasi enzim protease menggunakan metode Stanley et al. (1975) dengan
berbagai perlakuan kitosan (0 g; 0,1 g; 0,2 g; 0,3 g; 0,4 g; 0,5 g; 0,6 g; 0,7
g; 0,8 g; 0,9 g dan 1 g) dan dilanjutkan dengan uji kualitatif untuk mengukur
aktivitas enzim dan aktivitas spesifik enzim imobil.
Rancangan
percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan dua kali
ulangan. Kitosan yang dihasilkan pada penelitian telah memenuhi standar mutu
kitosan yang ditetapkan oleh PROTAN Jepang. Parameter mutu kitosan meliputi,
kadar abu sebesar 0%, kadar air 7%, kadar nitrogen 4,93%, derajat deasetilasi
95,3% dan viskositas sebesar 39,5%. Hasil analisis data terhadap aktivitas
enzim papain imobil, diperoleh ada satu perlakuan kitosan yang memberi pengaruh
berbeda nyata terhadap aktivitas enzim imobil yaitu perlakuan 1 g kitosan sedangkan
pada enzim bromelin imobil tidak ada perlakuan kitosan yang memberikan pengaruh
berbeda nyata. Aktivitas enzim papain imobil terkecil diperoleh pada perlakuan
0,6 g kitosan yaitu sebesar 0,0113 U/ml/menit dan aktivitas tertinggi sebesar
0,0190 U/ml/menit pada perlakuan 1 g kitosan.
Aktivitas
enzim bromelin imobil tertinggi juga diperoleh pada perlakuan 1 g kitosan yaitu
0,0108 U/ml/menit, sedangkan aktivitas terkecilnya diperoleh pada perlakuan 0,1
g kitosan dengan aktivitas 0,0011 U/ml/menit. Aktivitas spesifik enzim papain
imobil tertinggi yaitu sebesar 0,1432 U/mg protein enzim diperoleh pada
perlakuan 1 g kitosan, sedangkan aktivitas spesifik enzim terendah diperoleh
pada perlakuan 0,7 g kitosan dengan aktivitas spesifik 0,0940 U/mg protein
enzim. Aktivitas spesifik enzim bromelin imobil terkecil diperoleh pada
perlakuan 0,1 g kitosan dengan aktivitas 0,0036 U/mg protein enzim, sedangkan
aktivitas spesifik enzim imobil tertinggi yang dihasilkan sebesar 0,0733 U/mg protein
enzim diperoleh pada perlakuan 1 g kitosan.
Daftar Pustaka
Hendri, Jhon. Dkk. 2008. POLIMER KITIN SEBAGAI MEDIA PENDUKUNG AMOBILISASI ENZIM α-AMILASE. Tersedia online pada http://repository.usu.ac.id/bitstream/123456789/15925/1/sti-nov2005-%20(5).pdf. Tanggal 17
November 2010.
Mardinah, elida. 2008. PEMANFAATAN KITOSAN DARI
CANGKANG UDANG SEBAGAI MATRIKS PENYANGGA PADA IMOBILISASI ENZIM PROTEASE.
Tersdian online pada http://eprints.undip.ac.id/22254/1/B-02.pdf. online
tanggal 17 November 2010.
Setiawan, Heru. 2010. IMMOBILISASI ENZIM GLUCOSE
OXIDASE (GOD) dan HORSE RADISH
PEROXIDASE (HRP) DENGAN METODE SOL-GEL. Tersedia online pada http://jurnal.pdii.lipi.go.id/admin/jurnal/26973237.pdf . pada
tanggal 17 November 2010.
Simatupang, Ratna. 2008. ISOLASI DAN AMOBILISASI SEL/ENZIM BETA GALAKTOSIDASE. Tersedia online pada http://unand.org/jrk/wp-content/uploads/2010/04/6.pdf. Tanggl 17
November 2010.


Komentar
Posting Komentar